

癌症是一种涉及复杂分子网络的系统性异质性疾病。肿瘤形成涉及上皮-间质转化 (EMT),这促进了癌细胞的转移和可塑性。最近的实验提出,癌细胞可以通过药物组合转化为脂肪细胞。然而,从分子网络的角度来看,这些药物如何发挥作用的潜在机制仍然难以捉摸。
于海洋研究员在Advanced Science在线发表题为“Energy Landscape Reveals the Underlying Mechanism of Cancer-Adipose Conversion in Gene Network Models”的研究论文。为了揭示癌症-脂肪转化(CAC)的机制,本研究采用系统生物学方法,结合数学建模和分子实验,基于潜在的分子调控网络。
确定了四种类型的吸引子,对应于CAC景观上的上皮(E)、间质(M)、脂肪(A)和部分/中间EMT(P)细胞状态。景观和过渡路径结果表明,中间状态在癌症到脂肪的转变中起着关键作用。通过景观控制方法,确定了两种促进CAC的新型药物组合治疗策略。这些预测通过不同细胞系中的分子实验得到验证。这种结合计算和实验的方法为探索癌症网络中细胞命运转变的分子机制提供了强有力的工具。研究结果揭示了控制CAC的中间细胞状态的潜在机制,并确定了诱导癌症脂肪生成的新潜在药物组合。

癌症形成是一个复杂的过程,具有多种过渡状态,由潜在的基因调控网络控制。肿瘤细胞经历上皮-间质转化(EMT)和间质-上皮转化(MET),以实现可塑性和转移。EMT过程增强了癌细胞的可塑性,并被认为有助于癌症转移。有人提出,经历EMT和/或MET的细胞会进入高度可塑性的状态,这可能为治疗干预提供关键窗口。例如,最近的研究表明,癌细胞可以通过特定的治疗组合转化为脂肪细胞。然而,目前尚不清楚驱动这种癌症-脂肪转化(CAC)的潜在机制。这促使作者探索控制CAC中细胞命运决定的潜在分子调控网络。
动态建模方法提供了有效的工具来分析生物网络的功能和行为,例如EMT和癌症网络。同时,由于细胞内部的内在波动和作用于细胞的外部波动,在决定细胞命运时需要考虑随机描述。能量景观理论建立在经典的沃丁顿表观遗传景观隐喻之上,已被发展用于研究基因调控网络的随机动态,例如在发育和癌变过程中发生的随机动态。从景观的角度来看,细胞类型可以通过景观上的吸引盆地来表征,这反映了不同细胞类型出现的概率。具有较低潜力(或较高概率)的状态代表吸引子或生物功能状态,并构成吸引盆地或稳定状态。从这个角度来看,肿瘤发生或分化等生物过程可以理解为在底层基因调控网络的基因表达状态空间中从一种吸引子状态到另一种状态的转变。此外,可以通过最小作用路径方法从景观中量化吸引子或细胞类型之间的动态转换路径。这些方法可以深入了解转变过程中基因激活或失活的序列,并作为探索细胞从癌变到脂肪的转变机制的强有力的概念/理论工具。
在本研究中,作者通过应用景观理论揭示了CAC的机制。作者首先构建一个涉及EMT和脂肪生成调控网络的基因网络模型。基于CAC模型,作者量化能量景观以研究该过程的随机动力学。作者在景观上确定了四种类型的吸引子,它们分别表征上皮肿瘤状态(E)、间质肿瘤状态(M)、脂肪状态(A)和两个部分/中间EMT状态(P1和P2)。为了量化CAC中的转变过程,作者计算了每个转变的动力学转变路径。根据转变路径结果,作者提出CAC可以解释为从E或M肿瘤细胞状态到A细胞状态的转变,这与批量RNA测序结果非常吻合。为了探索药物诱导的CAC的潜在分子机制,作者在CAC基因网络模型中研究了不同的药物组合。作者发现TGF-β促进M状态的形成,MEKi在一定水平的TGF-β作用下促进P状态的形成,而罗格列酮在TGF-β和MEKi作用下促进A状态的形成,这些结果支持了恶性肿瘤细胞有可能经历部分EMT状态而转变为脂肪细胞的假说。更重要的是,景观结果从分子调控网络的角度为CAC通过中间细胞状态的机制提供了可能的理论解释。
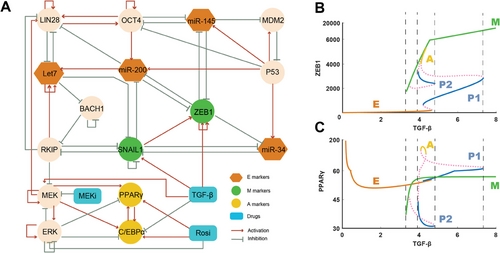
为了使用景观模型推断可能诱发CAC的其他药物组合,作者专注于精确定位CAC的关键分子调控元件。通过采用基于CAC基因网络模型的景观控制策略,作者确定了两种最佳药物组合。一种是ZEB1激活剂与罗格列酮的组合,另一种是MDM2激活剂与罗格列酮的组合。
为了验证作者对所提议药物组合疗效的预测,作者使用肝癌、乳腺癌和结肠癌细胞系进行了实验。作者对这些细胞进行了油红染色,以检测脂滴积聚,这表明脂肪细胞分化。通过流式细胞术进行的免疫荧光染色和BODIPY检测显示,在用ZEB1激活剂和罗格列酮治疗后,肿瘤细胞内的脂滴显著增加。此外,Western Blot分析证实了脂肪细胞特异性蛋白水平升高,而RT-PCR检测显示,在用联合药物治疗后,脂肪细胞相关基因的mRNA水平增加。额外的RNA-seq数据分析表明,用联合药物治疗的癌细胞会转化为与成熟脂肪细胞更相似的细胞。这些实验验证了作者的模型预测,因此支持了ZEB1激活剂和罗格列酮可能是诱导转移性肿瘤细胞向脂肪细胞转变的有效药物组合。
作者的研究结果为癌症-脂肪转化(CAC)提供了全面而定量的视角,通过对底层分子调控网络的洞察,增强了对这一转变过程的机制理解。通过将计算模型与分子实验相结合,作者建立了一个强大的框架来检查肿瘤细胞中细胞命运决定的随机性和动态性,从而为癌症治疗的创新方法奠定了基础。